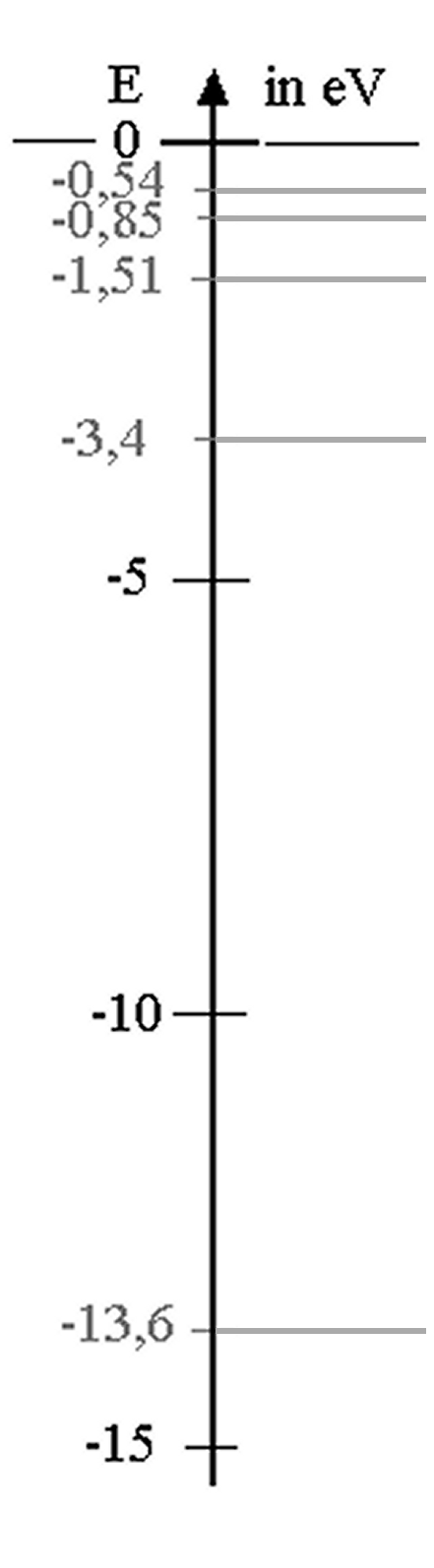|
Bohr'sches
Atommodell - ein Revival ?
Entwicklung
einer Gesetzmäßigkeit am Beispiel der Balmer-Formel mit
einer Tabellenkalkulation
|
1. Problematik:
 |
In der Didaktik der Schulphysik ist das Bohr'sche Atommodell
(BAM) aus verständlichen Gründen in Verruf geraten. Es widerspricht
in zu vielen Punkten der etablierten Quantenphysik. Dazu gehören
die Annahme von gleichzeitig be-stimmten
Werten für Bahnradius r und Bahngeschwindigkeit v des angeblich
kreisenden Elektrons oder von gleichzeitig be-stimmten
Werten für kinetische und potenzielle Energie oder Gesamtenergie.
Überflüssigerweise scheinen Schulbuchautoren gerade auf
problematische Aspekte - Bahnkurve und Umlaufsgeschwindigkeit -
besonderen Wert zu legen.
Meines Erachtens zeigt aber das Bohr'sche Modell in einer für
Schüler durchsichtigen Weise die Existenz diskreter
Energiestufen im H-Atom und Folgerungen daraus für die Abgabe
und Aufnahme von Energie durch das Atom.
Man kann Balmers/Bohrs Überlegungen geradezu als die Entdeckung
der Energiestufen des Atoms auffassen. Ich halte deshalb
die Behandlung dieses Aspekts in der Schule für unverzichtbar.
Hier möchte ich einen Weg aufweisen, wie die sicher falschen
Aspekte des Bohr'schen Modells zurückgedrängt und die korrekten
energetischen Aspekte in den Vordergrund geschoben werden
können.
|
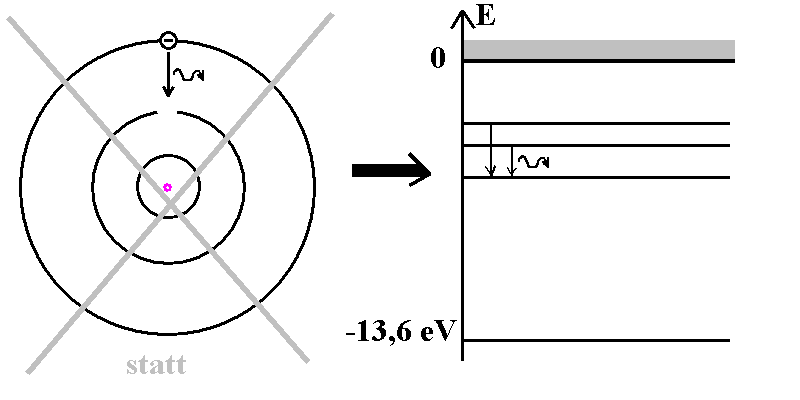
| Abb. 1: Statt über
Bahnen von Energiestufen sprechen! |
|
2. Vom Spektrum zur Energieformel:
Das soll mit einem Tabellenkalkulationsprogramm geschehen, mit dem die
beobachteten Photonenenergien der Balmer-Serie so analysiert werden,
dass die diskreten Energiestufen des H-Atoms erkennbar werden.
Im besten Fall eignet sich diese Untersuchung dann sogar als
Schülerversuch, mit dem die Sch lernen, wie mit geeigneten Hypothesen eine
mathematische Gesetzmäßigkeit "erraten" werden kann.
Im Buch
Schüleraktivierende Unterrichtsmaterialien, Band 3, Atomphysik, BoD,
Norderstedt, 2009, ISBN 978-3-8370-1321-4
sind Unterrichtsmaterialien bereit gestellt, die das folgende Programm
in Aufgaben aufteilen, die von Schülern bewältigt werden können.
Die Spalten 3 und 4 der folgenden Tabelle enthalten die
Eingangsdaten Photonenenergie E und Nummer n des Energieübergangs. Die
übrigen Spalten ergeben sich um Laufe der Entwicklung.
|
E0
|
i = n + 2
|
E
|
n
|
E0 - E
|
n
|
1/(E0-E)
|
n
|
√[1/(E0-E)]
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
| 3,40 |
3 |
1,89 |
1 |
1,51 |
1 |
0,66 |
1 |
0,81 |
| 3,40 |
4 |
2,55 |
2 |
0,85 |
2 |
1,18 |
2 |
1,08 |
| 3,40 |
5 |
2,86 |
3 |
0,54 |
3 |
1,84 |
3 |
1,36 |
| 3,40 |
6 |
3,02 |
4 |
0,38 |
4 |
2,65 |
4 |
1,63 |
| 3,40 |
7 |
3,12 |
5 |
0,28 |
5 |
3,60 |
5 |
1,90 |
| 3,40 |
8 |
3,19 |
6 |
0,21 |
6 |
4,71 |
6 |
2,17 |
| 3,40 |
9 |
3,23 |
7 |
0,17 |
7 |
5,96 |
7 |
2,44 |
| 3,40 |
10 |
3,26 |
8 |
0,14 |
8 |
7,35 |
8 |
2,71 |
| 3,40 |
11 |
3,29 |
9 |
0,11 |
9 |
8,90 |
9 |
2,98 |
| 3,40 |
12 |
3,31 |
10 |
0,09 |
10 |
10,59 |
10 |
3,25 |
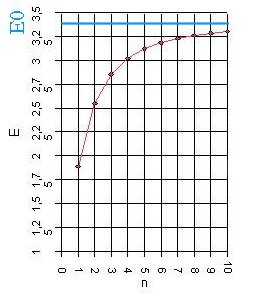 |
Abb. 2: Zuerst wird die
gemessene Photonenenergie E gegenüber einer Nummer n = 1,2,3, ...
aufgetragen. Nach dem Graphen könnte man eine Asymptote vermuten,
also einen Grenzwert E0 für die Energien; man vermutet
E0 zwischen 3,3 eV und 3,5 eV. Wir wählen E0
= 3,4 eV. |
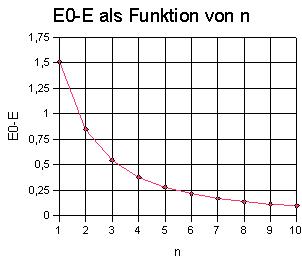 |
Abb. 3: E0 -
E als Funktion von n strebt gegen 0 für n gegen unendlich. Es
könnte sich um eine Hyperbel handeln, versuchsweise wird 1/(E0-E)
gegenüber n aufgetragen. |
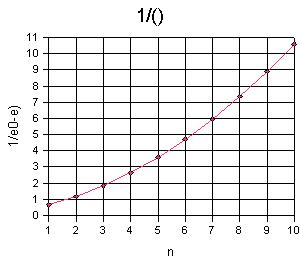 |
Abb. 4: Der Graph ist
immer noch stark gekrümmt. Es könnte sich um eine Parabel handeln
mit dem Scheitel links von n = 1. Zieht man also die Wurzel,
könnte sich eine Gerade ergeben. |
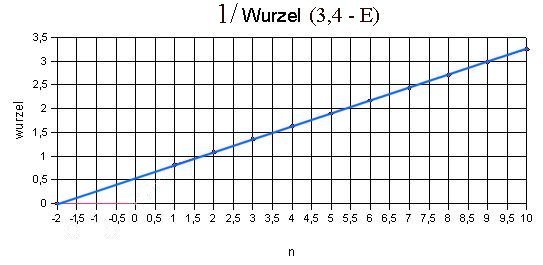 |
Abb. 5: Das ist
tatsächlich der Fall; man kann leicht entnehmen, dass der Scheitel
bzw. der Nullpunkt der Geraden mit Steigung c bei n = -2 liegen.
Daraus ergibt sich für das Quadrat ( E0 = 3,4 eV)
1/(E0-E) = c2 · (n+2)2
bzw.
E = E0 - 1 / { c2 (n+2)2} .
|
Umbenennung (i = n+2) führt auf Ei = E0
- 1/ c2 · 1/i2.
c entnimmt man dem Graphen: Für n = 8, also i = n + 2 = 10 erhält man
nach dem Graphen 1/√( - ) = 2,7. c ist also 2,7/10 =
0,27. 1/c2 ergibt 13,7. Anderseits ergibt sich für c =
0,271 der genauere Wert 1/c2 = 13,6.
Durch Probieren erhält man die optimale Ausgleichsgerade für E0
= 3,4 = 13,6 / 4, also Ei = 13,6 · ( 1/4 - 1/i2)
.
Damit lautet die Balmerformel endgültig (jetzt wieder mit Benennungen)
für die Photonenenergie Ei mit der Nummer i = 3, 4, 5,
... :
| Ei
= 13,6 eV · ( 1/4 - 1/i2)
( i = 3,4,5, ... )
|
3. Die Entdeckung der Energiestufen im BAM:
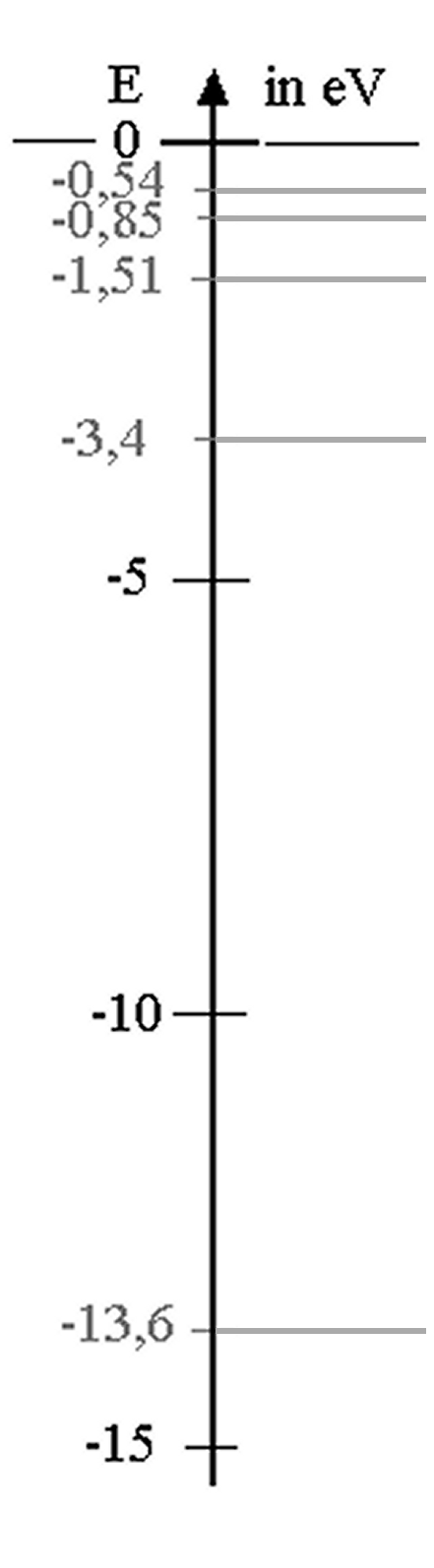 |
Abb. 6:
1. Das ist die Entdeckung von Energieniveaus in Atomen! Für die
n-te Energiestufe des Atoms wird der Ansatz gemacht:
| En = - 13,6 eV /n2
( n
= 1, 2, 3, ... ). |
2. Daraus ergibt sich ein Energiestufenschema gemäß der
Abbildung links.
3. Übergänge durch Strahlung: Die Photonenenergie Ei
entspricht der Differenz zwischen zwei Energiestufen: Ei
= En - E2 (n > 2). Bei der Balmer-Serie
enden alle Übergänge auf der Energiestufe mit n = 2.
|
| 4. Das Bohr'sche Modell des H-Atoms
a) Das Atom hat feste Energiestufen En ;
nur solche Energien sind erlaubt.
b) Strahlung (Abgabe von Photonen) und Energieaufnahme
(Aufnahme von Photonen) erfolgt nur durch Übergang von einer
Energiestufe auf eine andere. Die Photonenenergie entspricht der
Energiedifferenz.
c) Das Elektron ist durch die Coulomb-Kraft an den Kern
gebunden.
d) Der Drehimpuls ist gequantelt, d.h. auch für ihn gibt es
nur ganz bestimmte natürliche Zahlen n mit m·v·2·r·π =
n·h, wobei n eine natürliche Zahl, oder auch:
p·r = n·ħ wobei ħ
= h/(2·π)
|
.
5. Einige problematische Zusatzaspekte:
- Beim BAM wird fälschlich angenommen, dass ein Elektron auf einer
festen Kreis-Bahn um den Kern läuft mit bestimmten Geschwindigkeiten.
Diesen Aspekt würde ich nicht dadurch vertiefen, dass ich die Bahnkurve
zeichne oder gar "Elektronensprünge" von Bahn zu Bahn visualisiere. Die
Strahlung hat ja mit einer Ortsveränderung gar nichts zu tun.
- Beim BAM sollen Elektronen zugleich kinetische und potenzielle Energie
haben und als Folge der Coulomb-Kraft soll auf der Kreisbahn gelten: Ekin
= - 1/2 Epot bzw. Epot = -
2 Ekin Daraus ergibt sich:
E = Ekin + Epot = 1/2 Epot =
- Ekin
Das folgt klassisch für eine
Kreisbahn aus dem Coulomb-Gesetz.
6. Quantitative Charakteristika des Bohr'schen
Atommodells:
(1) Für die Coulomb-Kraft gilt genauso wie für das
Gravitationsgesetz: Aus F = α /r2
folgt Epot = - α/r . Für das Coulomb-Gesetz gilt dabei α
= 1/(4·π·ε0 ) · Ze2 mit der elektrischen
Feldkonstanten ε0 = 8,85·10-12 As/Vm und der
Kernladungszahl Z bei "wasserstoffähnlichen" Atomen. Das wird in Abschnitt
9 bewiesen.
(2) Ekin = p2/2·m = m/2 v2
= - 1/2 Epot = α/2r ("Energiebedingung"
als Folge des Coulomb-Gesetzes bei einer Kreisbahn mit Radius r) und
damit: E = Ekin + Epot =
1/2 Epot = - Ekin. m = 9,1·10-31
kg ist dabei die Masse des angeblich umlaufenden Elektrons.
(3) m·v·2·r·π = n·h,
wobei n natürliche Zahl ("Quantenbedingung")
bzw. p = n·h/(2·r·π) oder p·r= n·ħ
( 𝓁 = p·r wird auch als Drehimpuls eines Teilchens mit dem Impuls p auf
einer Kreisbahn mit dem Radius r bezeichnet. Die Quantenbedingung lautet
dann 𝓁 = n·ħ mit ħ =
h/(2·π))
7. Wie lässt sich die Herleitung von r und v vermeiden?
Mit der "Energiebedingung" (1) und der Quantenbedingung (2)
lassen sich relativ leicht r oder v für die "n-te Quantenbahn" berechnen,
und daraus die richtige Energie E. Für r und v könnten Sie ein sicher nicht
haltbares Zwischenergebnis erhalten: Atome sind keine klassischen
Planetensysteme. Dieser Aspekt sollte deshalb nicht vertieft werden. Die
Energie dagegen stimmt nach dieser Rechnung mit allen experimentellen
Folgerungen (in einem weiten Maß) überein.
Einen möglichen direkten Weg zur Energie, der die Herleitung von r und v
vermeidet, finden Sie unten.
8. Hinweise:
(1) Dass Epot = - α/r mit der
Coulomb-Kraft zusammenhängt - klassisch argumentierend, wird durch
Ableitung gezeigt: d Epot / dr = α/r2
= - Fc bei einer anziehenden Coulomb-Kraft zwischen zwei
Ladungen Ze und -e.
(2) Dass Ekin = - 1/2 Epot (1) beim
Coulomb-Potential für eine Kreisbahn folgt - klassisch argumentierend -
aus dem Kraftansatz: Die Coulomb-Kraft wirkt als Zentripetalkraft: mv2/r
= α/r2 , also mv2/2 = α/2r = - 1/2 Epot.
(Nur bei einer Kreisbahn ist mv2/2 die gesamte kinetische
Energie). Im allgemeinen Fall gilt eine entsprechende Beziehung nur für
die Mittelwerte (Virialsatz).
(3) Mit der Beziehung (1) zu argumentieren und ihre Begründung nach
Gebrauch nachzuschieben erscheint mir als sinnvoller Trick, aufwändige
(und doch nur klassisch gültige) Rechnungen (für r und v) zu reduzieren.
Primäres Ziel der Rechnung könnte dann sein, die Gesamtenergie
(basierend auf 13,6 eV) relativ schnell mit der Coulomb-Kraft und
allgemeinen Konstanten zu begründen und nicht, Formeln für r oder v der
"n-ten Quantenbahn" zu berechnen, obwohl der sogenannte klassische
Atomradius r0 = 0,5·10-10 m für den Grundzustand
für Vorstellung und Abschätzungen nicht uninteressant ist.
Der klassische Atomradius r0
ist aber eine reine Rechengröße. Er vermittelt ein Gefühl für die Größe
eines Atoms. Tatsächlich würde man bei wiederholten Messungen das
Elektron in jedem beliebigen Abstand vom Kern finden, am häufigsten
allerdings in der Nähe des klassischen Atomradius, wie
es auch das quantenmechanische Atommodell beschreibt.
(4) Hoch angeregte Rydberg-Atome
(n > 60) verhalten sich in einem hohen Maß wie klassische Bohr'sche
Atome. Beim Energie-Übergang von n auf n-1 stimmt sogar die
Umlaufsfrequenz mit der Frequenz der abgestrahlten elektromagnetischen
Welle recht gut überein. Dies sehe ich als ein weiteres Argument dafür an,
dass das BAM in der Schule behandelt werden sollte.
(5) Beim H-Atom ist es gleichgültig, ob man von Energiestufen des
Elektrons oder des Atoms spricht. Bei Mehrelektronenatomen hat streng
genommen nur das Atom diskrete Energiestufen. Nur in vereinfachten
Näherungs-Modellen, z.B. dem Schalenmodell, tut man so, als haben auch die
Elektronen selbst be-stimmte Energiestufen.
(6) Wegen der gleichen Struktur von Coulomb-Kraft und Gravitationskraft
(beide prop. 1/r2) gilt die Energiebedingung auch bei der
Kreisbahn von Planeten. Das erlaubt einfache Abschätzungen für die
Bewegung von Planeten um die Sonne oder von Satelliten um die Erde. Beim
Gravitationsgesetz gilt α = G·m1·m2 mit G =
6,67·10-11m3kg-1s-2 .
9. Anhang: Widersprüche des Bohr'schen Atommodells zur
Realität und zum quantenmechanischen Atommodell:
(1) Es kann keine Bahnen von Elektronen im Atom geben; das
widerspricht der Heisenberg'schen Unbestimmtheitsrelation
(HUR). Radius und Impuls/Geschwindigkeit können nicht gleichzeitig be-stimmt
sein. Sie sind komplementär zueinander.
Messungen des Orts oder der Geschwindigkeit (des Impulses) ergeben in den
beschriebenen Zuständen streuende Messwerte: Das Elektron kann überall im
Atom mit beliebiger Geschwindigkeit gefunden werden.
(2) Ekin oder Epot können nicht
gleichzeitig mit der Gesamtenergie E be-stimmt sein. Ebenso
können auch Ekin und Epot nicht gleichzeitig be-stimmt
sein. Auch das wäre ein Widerspruch zur HUR. Je zwei dieser Größen sind
komplementär. (Dagegen sollten auch schulische Herleitungen mit der
Schrödinger-Gleichung nicht verstoßen.)
(3) Das H-Atom müsste flach wie eine Scheibe sein; tatsächlich
"kugeliger Aufbau". Wir wissen: Ein Elektron in einem stationären Zustand
mit einem be-stimmten Energieeigenwert "kreist" nicht. Es gibt im Atom
keine Bewegung im klassischen Sinn. So gibt es keinen Grund, weshalb eine
Kreisbahn die Geometrie des Atoms bestimmen sollte. Das Elektron kann bei
Messungen überall im Atom gefunden werden.
(4) Energieänderungen sind nicht unbedingt mit Ortsveränderungen
(Hüpfen von einer Bahn auf eine andere) verbunden. Weder vor, noch nach
der Energieänderung hat ja nach der Quantentheorie das Elektron ohne eine
Messung einen Ort. "Quantensprünge" in diesem Sinne gibt es also nicht.
(5) Die magnetischen Eigenschaften des H-Atoms kommen falsch
heraus. Das klassisch im H-Atom kreisende Elektron müsste wie ein
Kreisstrom ein Magnetfeld erzeugen. Das ist für den Grundzustand nicht der
Fall, wie schon die erweiterte Bohr-Sommerfeld-Theorie zeigte. Dann wäre
das H-Atom also nicht paramagnetisch. Das widerspricht aber den
Experimenten, weil auch der Elektronenspin eine Rolle spielt. Allein wegen
des Elektronenspins ist das H-Atom im Grundzustand paramagnetisch.
(Bei der überholten Bohr-Sommerfeld-Theorie sind zusätzlich zu
den Kreisbahnen auch Ellipsen zugelassen. Bahnen mit gleicher großer
Halbachse gehören zur gleichen Hauptquantenzahl n (zur gleichen
Energie). Die verschiedenen Ellipsenformen werden durch die
Bahndrehimpulsquantenzahl 𝓁 unterschieden.)
(6) Es wird nicht erklärt, weshalb das kreisende Elektron nicht wie ein
Dipol elektromagnetische Wellen abstrahlt. Dann müsste es nämlich wegen
des Energieverlusts in den Kern "spiralen" und das Atom instabil machen.
Wir wissen: Ein Elektron in einem stationären quantenmechanischen Zustand
mit einem be-stimmten Energieeigenwert "kreist" nicht, weil es nicht eine
Folge von Orten durchläuft. So gibt es keinen Grund, weshalb es strahlen
sollte.
(7) Damit hängt zusammen: Die Umlaufsfrequenz müsste sich beim BAM im
Laufe eines Strahlungsvorgangs verändern. Dabei sollte sich auch die
Frequenz des abgestrahlten Lichts verändern. (Ein schwingender Dipol
strahlt eine elektromagnetische Welle gleicher Frequenz ab): Ein
H-Atom-Gas sollte nicht die Balmer-Serie abstrahlen, sondern weißes Licht
mit Photonen aller Energien.
(8) Es wird nicht erklärt, weshalb der Drehimpuls gequantelt sein soll.
Tatsächlich zeigt die Quantentheorie des H-Atoms (wie auch schon die
Bohr-Sommerfeld-Theorie), dass es zur Hauptquantenzahl n mehrere
Drehimpulsquantenzahlen 𝓁 (für den Bahndrehimpuls) geben kann: 𝓁 = 0, 1,
... n-1. Für den Grundzustand mit n = 1 ist also nur eine einzige
Drehimpulsquantenzahl (𝓁 = 0) möglich. (Deshalb also gibt es im
Grundzustand keinen "Bahnmagnetismus", sondern nur den "Spinmagnetismus").
(9) Weitere Details der Strahlung (z.B. die so genannte Feinstruktur)
lassen sich so nicht erklären. Generell wird der Elektronenspin wie der
Kernspin außer acht gelassen.
(10) Es sind keine Aussagen über die Intensität der Spektrallinien
möglich.
(11) Das Bohr'sche Atommodell lässt sich kaum auf Atome mit mehr als
einem Elektron erweitern.
(12) Die Quantenphysik lehrt, dass es - streng genommen - in einem
Mehrelektronen-Atom ohne Messung auch keine individuellen Elektronen gibt.
Bereits beim He-Atom gibt es ohne eine Messung keine zwei individuellen
Elektronen mit be-stimmten Eigenschaften. Wir wissen: Die Wellenfunktion
der Schrödinger-Gleichung ist in diesem Fall eine Welle in einem
6-dimensionalen Raum. Erst durch eine Messung entstehen individuelle
Eigenschaften von Elektronen. (Mit Näherungsmethoden setzt man sich
manchmal über diese Tatsache hinweg.)
10. Anhang: Herleitung der Energiezustände des
BAM:
Ausgangspunkt sind:
| (1) die "Energiebedingung":
Eges = - Ekin =
1/2 Epot
und
(2) die "Quantenbedingung":
p·r = n·ħ
wobei p·r = m·v·r
mit ħ = h/(2·π) , wobei n eine
natürliche Zahl ist.
|
( 𝓁 = p·r = n·ħ p·r = n·ħ
wird auch als Drehimpuls eines Teilchens mit dem Impuls p auf einer
Kreisbahn mit dem Radius r bezeichnet. )
Ekin ist prop. zu p2, Epot prop. 1/r. Um
p·r ins Spiel zu bringen, ist die Kombination Ekin/E2pot
oder ihr Kehrwert geeignet.
Sie erhalten: Ekin/E2pot = p2/2·m /(α/r)2
= p2r2/(2mα2) = n2·ħ2/(2mα2)
Wegen der Energiebedingung gilt Ekin/E2pot =
1/(4·Ekin), und schließlich:
Ekin = (mα2/2)·1/(n2·ħ2)
n ε N,
insgesamt also für die Gesamtenergie im n-ten Zustand:
En = - Ekin = - (m·α2/2) 1/(n2·ħ2)
n ε N
oder mit α = 1/(4·π·ε0 ) · Ze2 und ħ
= h/(2·π)
En = - (Z2·m·e4)/(8·ε02·h2)·1/n2
bzw.
| En = E1 ·1/n2 ,
wobei n ε N |
mit der Grundzustandsenergie E1 = - (Z2·m·e4)/(8·ε02·h2)
, wobei n ε N.
Auf diese Weise können Sie ohne Herleitung von r und v die Energiestufen
En des Wasserstoffatoms erhalten. In der Diskussion dieses
Ergebnisses wird das Energieniveau-Schema von Abb. 6 bestätigt.
*) Mit der nicht duden-gemäßen
Schreibweise von "be-stimmt"
wird angedeutet, dass es sich um das quantenphysikalische Fachwort und
nicht um das gleichlautende umgangssprachliche Wort handelt.
Download: balmer_leer.xls
balmer_leer.ods
( März 2016 : Zeichensatz geändert; 2024: überarbeitet )